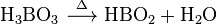- 英
- boric acid BA、borate
- ラ
- acidum boricum
- 商
- カーディオライト、ケトチフェン、スコピゾル、マイティア
- 関
- ホウ酸塩
WordNet
- a salt or ester of boric acid
PrepTutorEJDIC
- 硼酸塩,硼酸エステル
Wikipedia preview
出典(authority):フリー百科事典『ウィキペディア(Wikipedia)』「2015/06/30 11:07:32」(JST)
wiki ja
UpToDate Contents
全文を閲覧するには購読必要です。 To read the full text you will need to subscribe.
- 1. カンジダ性外陰膣炎 candida vulvovaginitis
- 2. 細菌性膣炎 bacterial vaginosis
- 3. 乳幼児におけるおむつ皮膚炎の概要 overview of diaper dermatitis in infants and children
- 4. 慢性化膿性中耳炎(CSOM):予防、治療、予後、および合併症 chronic suppurative otitis media csom prevention treatment prognosis and complications
- 5. 耳垢 cerumen
Japanese Journal
- 2Pb1-7 リチウムセシウムホウ酸塩ガラス、結晶およびその融液の高温における弾性的性質(ポスターセッション)
- 荒籾 俊介,小玉 正雄,小島 誠治
- 超音波エレクトロニクスの基礎と応用に関するシンポジウム講演論文集 (32), 189-190, 2011-11-08
- NAID 110008913368
- クロモトロープ酸を担持した陰イオン交換カラムを用いる超微量ホウ酸のオンライン濃縮/HPLC定量法の改良と沖縄県西表島の天然水分析への応用
- 姚 俊学,吉村 和久,栗崎 弘輔,井倉 洋二,高相 徳志郎
- 分析化学 = Japan analyst 60(10), 785-789, 2011-10-05
- … .その吸光定量を350 nmで行った.試料3.2 cm3を用いたときの分析時間は約12分,検出限界は0.06 μg dm−3であった.既報に比べて,分析時間および感度を大幅に改善できた.本法を琉球列島西表島の天然水中のホウ酸の分析に応用した.降雨および二つの河川水中のホウ素濃度は,それぞれ3.1〜40.8,20.3〜28.5,14.7〜20.9 μg dm−3であった.いずれの場合も,非海塩性由来のホウ素の分率は高く,アジア大陸からの長距離移流 …
- NAID 10029482329
Related Links
- ホウ酸(日用品・文具)の検索結果。全国の通販ショップから、≪人気≫ホウ酸を比較できます。価格比較サイトのビカムで、日用品・文具カテゴリ内から、アースゴキブリホウ酸ダンゴコンクゴキンジャム【J】【ポンパレモール ...
- ホウ酸(ダイエット・健康)の検索結果。全国の通販ショップから、≪人気≫ホウ酸を比較できます。価格比較サイトのビカムで、ダイエット・健康カテゴリ内から、ホウ酸 結晶 500g【第3類医薬品】【ポンパレモール】などの商品 ...
Related Pictures
Japan Pharmaceutical Reference
薬効分類名
- アレルギー性鼻炎治療剤
販売名
ケトチフェンネーザル0.05%「TYK」
組成
成分
- 日局 ケトチフェンフマル酸塩
含量
- 8mL中 6.048mg(ケトチフェンとして4.398mg)
添加物
- ポビドン、ベンザルコニウム塩化物、グリセリン、リン酸二水素カリウム、ベンジルアルコール、ホウ酸、ハッカ油、pH調整剤
効能または効果
- アレルギー性鼻炎
- 通常、1日4回(朝、昼、夕方及び就寝前)、1回各鼻腔に1噴霧(ケトチフェンとして0.05mg)ずつ、鼻用定量噴霧器を用いて噴霧吸入する。
薬効薬理
作用機序
- ケトチフェンフマル酸塩は、ケミカルメディエーター遊離抑制に基づく抗アナフィラキシー作用に加え、抗ヒスタミン作用、抗SRS-A作用及び抗PAF(血小板活性化因子)作用を有し、気道及び鼻粘膜等の組織の過敏性を減弱させる。更に、抗原/PAF刺激による好酸球の肺への集積とそこでの脱顆粒を抑制する作用もあり、また、抗原により誘発される結膜炎症状や鼻粘膜反応も抑制する1)。
生物学的同等性
- 本剤はアレルギー性鼻炎実験動物モデルを用いた薬力学的試験により、標準製剤との生物学的同等性が確認されている。
TDI感作モルモットにおける誘発症状の抑制
- TDI(Toluene 2,4-diisosyanate)を抗原とした鼻塗布感作モルモットにおいて、本剤及び標準製剤はコントロール群に比し誘発症状(くしゃみ、水溶性鼻汁、喘鳴)を有意に抑制し、両製剤間に有意差は認められなかった2)。
アルブミン感作モルモットにおける血管透過性亢進の抑制
- アルブミン吸入感作モルモットにおける鼻腔粘膜からの漏出色素量を指標とした血管透過性抑制試験において、本剤及び標準製剤はコントロール群に比し漏出色素量を有意に抑制し、両製剤間に有意差は認められなかった3)。
有効成分に関する理化学的知見
一般名
- ケトチフェンフマル酸塩、Ketotifen Fumarate(JAN)
[別名]フマル酸ケトチフェン
化学名
- 4-(1-Methylpiperidin-4-ylidene)-4H-benzo[4,5]cyclohepta[1,2-b]thiophen-10(9H)-one monofumarate
分子式
- C19H19NOS・C4H4O4
分子量
- 425.50
性状
- 白色〜淡黄白色の結晶性の粉末である。
メタノール又は酢酸(100)にやや溶けにくく、水、エタノール(99.5)又は無水酢酸に溶けにくい。
融点
- 約190℃(分解)
★リンクテーブル★
| リンク元 | 「眼科用剤」「オキソ酸」「デーキン液」「スコピゾル」「マイティア」 |
| 拡張検索 | 「ホウ酸塩」 |
| 関連記事 | 「酸」 |
「眼科用剤」
商品
- AZ
- D・E・X
- DMゾロン
- FAD
- HCゾロン
- PA・ヨード
- PSゾロン
- アイオピジンUD
- アイケア
- アイケアミニ
- アイドロイチン
- アイビナール
- アイファガン
- アズラビン
- アズレン
- アゾテシン
- アダプチノール
- アドソルボカルピン
- アトロピン
- アラジオフ
- アルギノン
- アレギサール
- アレニスト
- イソプロピルウノプロストン
- イソプロピルウノプロストンPF
- インタール
- インドメロール
- ウブレチド
- エイゾプト
- エコリシン
- エリコリ
- エリコリT
- エリックス
- オーハラキシン
- オキシブプロカイン塩酸塩ミニムス
- オゼックス
- オドメール
- オプール
- オフサリンP
- オフサロン
- オフタルギー
- オフテクター
- オフミック
- オフロキサシン
- オフロキサット
- オフロキシン
- オペガードMA
- オペガードネオ
- オペガン
- オペガンハイ
- オペリード
- オルガドロン
- オルカビット
- カタリン
- カタリンK
- ガチフロ
- カリーユニ
- カルテオロール
- カルテオロール塩酸塩
- ガレシロール
- キサトロン
- キサラタン
- クールウェイ
- クモロール
- クモロールPF
- クラビット
- クロモフェロン
- クロモリーク
- クロラムフェニコール
- ケタス
- ケトチフェン
- ケトチフェンPF
- ケトテン
- ゲンタロール
- コソプト配合
- コバラム
- コリナコール
- コンドロン
- コンドロンデキサ
- サイプレジン
- ザジテン
- ザラカム配合
- サンコバ
- サンチンク
- サンテゾーン
- サンドールMY
- サンドールP
- サンピロ
- サンベタゾン
- ジクアス
- ジクロード
- ジクロスター
- ジクロスターPF
- ジクロフェナック
- シズレミン
- スコピゾル
- スタフルミン
- スプデル
- セキトン
- ゼペリン
- ゾビラックス
- ソフティア
- タチオン
- タプロス
- タリキサシン
- タリザート
- タリビッド
- タリフロン
- タリムス
- チアブート
- チモプトール
- チモプトールXE
- チモレート
- チモレートPF
- チモロール
- ティアバランス
- テイカゾン
- ディスコビスク
- デタントール
- デュオトラバ配合
- トーワタール
- トスフロ
- トブラシン
- トラニラスト
- トラバタンズ
- トラメラス
- トラメラスPF
- トルソプト
- ニチカード
- ニプラジロール
- ニプラジロールPF
- ニプラノール
- ニフラン
- ネオシネジン
- ネオベノール
- ネオメドロールEE
- ネバナック
- ノイボルミチン
- ノキサシン
- ノスラン
- ノフロ
- ノフロキサン
- ハイパジールコーワ
- ハオプラ
- バクシダール
- バクファミル
- パタノール
- パニマイシン
- パピロックミニ
- バルライザー
- ヒアール
- ヒアガード
- ヒアルロン酸Na
- ヒアルロン酸ナトリウム
- ヒアルロン酸ナトリウムPF
- ヒアレイン
- ヒアロンサン
- ビーエスエスプラス
- ヒーロン
- ピオネス
- ビジュアリン
- ビスコート
- ビスコレット
- ビスダイン
- ビタコバール
- ピトス
- ピバレフリン
- ピマリシン
- ビルレクス
- ピレノキシン
- ファルキサシン
- ファルコバ
- ファルチモ
- フサコール
- フマルトン
- フマルフェン
- プラノプロフェン
- フラビタン
- プリビナ
- フルオメソロン
- フルオロメトロン
- フルメトロン
- プレドニン
- ブロキレート
- ブロキレートPF
- ブロナック
- フロバール
- プロビスク
- プロラノン
- ベガモックス
- ベギータ
- ベストロン
- ベタキール
- ベタキソン
- ベトプティック
- ベトプティックエス
- ベナンザ
- ベノキシール
- ペミラストン
- ペミリドン
- ベルベゾロン
- ベルベゾロンF
- ホウ砂
- ホウ酸
- ボナフェック
- マイティア
- マイピリン
- マキュエイド
- マクジェン
- マゴチフェン
- マリオットン
- マロメール
- ミオピン
- ミケラン
- ミケランLA
- ミタトニン
- ミタヤク
- ミドリンM
- ミドリンP
- ミロル
- ムコスタ
- ムコゾーム
- ムコティア
- ムコファジン
- ムコロイド
- ムルキナ
- メインター
- メルカトア
- ラクリミン
- ラタノプロスト
- ラタノプロストPF
- リエントン
- リザベン
- リズモン
- リズモンTG
- リゾティア
- リノロサール
- リフタマイシン
- リボスチン
- リュウアト
- リンデロン
- リンデロンA
- リンベタPF
- ルゲオン
- ルセンティス
- ルポック
- ルミガン
- レスキュラ
- レボカバスチン
- レボカバスチン塩酸塩
- レボブノロール塩酸塩
- レボブノロール塩酸塩PF
- レボフロキサシン
- ロメフロン
- ロメフロンミニムス
- 塩酸ピロカルピン
- 塩酸ベノキシネート
- 臭化水素酸ホマトロピン
- 酢酸プレドニゾロン
- 硫酸ゲンタマイシン
「オキソ酸」
。]] オキソ酸(オキソさん、Oxoacid)とは、ある原子にヒドロキシル基 (-OH) とオキソ基 (=O) が結合しており、且つそのヒドロキシル基が酸性プロトンを与える化合物のことを指す<ref>IUPAC Gold Book - oxoacids</ref>。ただし、無機化学命名法IUPAC1990年勧告のオキソ酸の定義では、先述した化合物の他にアクア酸(aqua acid)<ref>中心金属イオンに配位した水分子に酸性プロトンが存在する酸。例:ヘキサアクア鉄(III)イオン</ref>、ヒドロキソ酸(hydroxoacid)<ref>隣接するオキソ基が存在しないヒドロキシル基に酸性プロトンが存在する酸。例:オルトケイ酸 (H4SiO4)</ref>もオキソ酸に含まれることになる。無機化合物のオキソ酸の例としては硫酸や硝酸、リン酸などが挙げられる。有機化合物で最も重要なオキソ酸はカルボン酸である。酸性の強弱は化合物の種類によりさまざまなものがある。一般に、オキソ酸は多原子イオンと水素イオンを与える。
オキソ酸が脱水縮合することで、ポリオキソ酸が生成する。例えば、リン酸では二リン酸、三リン酸である。酸無水物も同様に、オキソ酸の脱水縮合生成物にあたる。遷移金属元素のオキソ酸は金属オキソ酸(ポリ酸)と呼ぶ。
ポーリングの規則
単核オキソ酸の酸性度の強さを推定する2つの経験則としてポーリングの規則(Pauling's rules)が知られている。
- 1, 中心元素 E のオキソ酸の化学式が EOm(OH)n で表されるときに、酸解離定数 Ka は次の関係式で表される。
- <math>\mbox{p}K_a = -\log K_a \approx 8 - 5m </math>
- 2, n>1の酸の逐次酸解離のpKa値はプロトン解離が1回起こる毎に5ずつ増加する。
ただし、この規則に従わないオキソ酸も存在する。例えば炭酸の推定値は3であるが実測値は6.4である。これは水溶液中に溶けている二酸化炭素が僅かしか炭酸にならないためである。このことを考慮に入れるとpKa値は規則通り約3.6となる。また、亜硫酸も規則に従わない。これは溶液中に亜硫酸分子は検出されず、さらにSO2が複雑な平衡を持っているからである。
- <math>\rm CO_2 + H_2O \ \overrightarrow\longleftarrow \ H_2CO_3</math>
- <math>\rm SO_2 + H_2O \ \overrightarrow\longleftarrow \ H^+ + HSO_3^-</math>
オキソ酸の一覧
脚注
テンプレート:脚注ヘルプ <references/>
関連項目
「デーキン液」
- 消毒薬
- 組成:炭酸ナトリウム、次亜塩素酸カルシウム Ca(ClO)2、ホウ酸
「スコピゾル」
「マイティア」
[★] ホウ酸、リン酸水素ナトリウム、塩化カリウム、塩化ナトリウム、乾燥炭酸ナトリウム
- 関
- 人工涙液
「ホウ酸塩」
「酸」