化学、生化学、薬理学において、解離定数(かいりていすう、)は、複合体がその構成分子へとばらばらになる時、あるいは塩がその構成イオンへと分かれる時に、より大きな方の対象物がより小さな構成要素へと可逆的に分離(解離)する傾向を測る特殊な平衡定数である。解離定数は結合定数の逆数である。塩についての特別な場合は、解離定数はイオン化定数とも呼ばれる。
複合体がx Aサブユニットとy Bサブユニットへと別れる一般的な反応

について、解離定数は以下のように定義される。
![K_{d} = \frac{[A]^x \cdot [B]^y}{[A_x B_y]}](//upload.wikimedia.org/math/7/f/6/7f62de1b550ec5bdc05c556bd5c4602d.png)
上式において、[A]、[B]、[AxBy] はそれぞれA、B、複合体AxByの濃度である。
生化学および薬理学において解離定数の人気がある一つの理由は、x=y=1となるしばしば見られる場合において、Kdが単純な物理学的解釈を有することである。[A]=Kdの時、[B]=[AB] あるいは [AB]/([B]+[AB])=1/2である。つまり、濃度の次元を有するKdは、Bの全分子の半数がAと会合している時の遊離のAの濃度に等しい。この単純な解釈はxあるいはyがより大きな値を取る場合には当てはまらない。また、競合反応が存在しないことも仮定されているが、競合的結合をあらわに扱い、記述できるように導出を拡張することができる。EC50やIC50が物質の生物学的活性を説明するのと同じように、解離定数は物質の結合の素早い説明として有用である。
目次
- 1 タンパク質-リガンド結合
- 2 酸-塩基反応
- 3 水の解離定数
- 4 脚注
- 5 関連項目
タンパク質-リガンド結合
解離定数はリガンド () (薬剤など)とタンパク質 () との間の親和性(すなわちリガンドが特定のタンパク質にどのぐらい強く結合しているか)を説明するために一般的に使われている。リガンド-タンパク質親和性は水素結合や静電相互作用、疎水性相互作用、ファンデルワールス力といった2分子間の非共有結合性相互作用によって影響を受ける。また、高濃度の他の高分子によっても影響を受け、分子クラウディングの原因となる[1][2]。
リガンド-タンパク質複合体()は2つの状態を含む過程によって記述できる。

対応する解離定数は以下のように定義される。
![K_{d} = \frac{\left[ \mathrm{P} \right] \left[ \mathrm{L} \right]}{\left[ \mathrm{C} \right]}](//upload.wikimedia.org/math/0/2/d/02d9662e84613b8f2ab83ae3d30de36c.png)
上式において、[]、[]、[] は、それぞれタンパク質、リガンド、複合体のモル濃度を表わす。
解離定数はモル濃度単位 (M) を持ち、特定のタンパク質の結合部位の半分が占有されるリガンドの濃度 [] に一致する。すなわち、リガンドが結合したタンパク質の濃度 [] がリガンドが結合していないタンパク質の濃度 [] と等しくなるリガンドの濃度である。解離定数が小さくなるとリガンドはよりしっかりと結合する、あるいはリガンドとタンパク質との間の親和性が高まる。例えば、ナノモーラー (nM) オーダーの解離定数を有するリガンドは、マイクロモーラー (M) オーダーの解離定数を有するリガンドよりも特定のタンパク質によりしっかりと結合する。
2分子間の非共有結合性相互作用によって生じるピコモーラーより小さい解離定数は稀である。にもかかわらず、いくつかの重要な例外が存在する。ビオチンとアビジンは、おおよそ M = 1 fM = 0.000001 nMの解離定数で結合する[3]。
また、リボヌクレアーゼインヒビタータンパク質もリボヌクレアーゼと同じような Mの親和性で結合できる[4]。特定のリガンド-タンパク質複合体に対する解離定数は溶液条件(例えば温度、pH、塩濃度)によって著しく変化する。異なる溶液条件の影響は、特定のリガンド-タンパク質複合体を結び付けている全ての非共有結合性相互作用の強さを効果的に変更する。
薬剤は、相互作用するように意図あるいは設計されていないタンパク質との相互作用によって有害な副作用を生じうる。ゆえに、たくさんの薬理学的研究が標的タンパク質のみに対して高い親和性(通常0.1-10 nM)で結合する薬剤の設計、あるいは特定の薬剤とそのin vivo標的タンパク質との間の親和性の向上を対象としている。
抗体
抗体 (Ab) が抗原 (Ag) に結合する特殊な場合においては、大抵は親和性定数が用いられる。これは解離定数の逆数である。
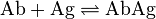
![K_{a} = \frac{\left[ \text{AbAg} \right]}{\left[ \text{Ab} \right] \left[ \text{Ag} \right]} = \frac{1}{K_{d}}](//upload.wikimedia.org/math/d/0/a/d0af9d86400d19d67b24c34cb1a1c325.png)
この化学平衡は、会合速度定数(kforward)と解離速度定数(kback)との比でもある。2つの抗体が同じ親和性を持つ場合もあるが、一方が高い会合速度定数と低い解離速度定数、他方が低い会合速度定数と高い解離速度定数を持つためかもしれない。

酸-塩基反応
詳細は「酸解離定数」を参照
酸の脱プロトン化に対するKは、酸解離定数Kaとして知られている。より強い酸、例えば硫酸あるいはリン酸がより大きな解離定数を持ち、酢酸のようなより弱い酸はより小さな解離定数を持つ。
酸解離定数は、  で定義されるpによって表わされることがある。
で定義されるpによって表わされることがある。
この表記は同様にその他の文脈でも見られる。共有結合の解離(すなわち化学結合の形成あるいは切断反応)では解離定数が非常に大きく変化するため、対数表記が主に用いられる。
分子は複数の酸解離定数を持ちうる。この点については、与えることができるプロトンの数に依存しており、一塩基酸、二塩基酸、三塩基酸を定義できる。一塩基酸(例えば酢酸やアンモニウム塩)は1つの解離性基のみを持ち、二塩基酸(炭酸、重炭酸塩、グリシン)は2つの解離性基、三塩基酸(例えばリン酸)は3つの解離性基を持つ。複数のpK値を持つ場合、それらはpK1やpK2、pK3といった指標によって指定される。アミノ酸では、pK1定数はカルボキシル基 (-COOH) を指し、pK2はアミノ基 (-NH3) を指し、pK3は側鎖のpK値である。
水の解離定数
詳細は「自己解離」を参照
水の解離定数はKwで示される。
水の濃度は、慣習によって省略される。これはKwの値が濃度を用いて計算されたKeqの値とは異なることを意味する。
Kwの値は、下記の表に示すように温度によって変化する。pHといった量の精密な測定を行う時にはこの変化を考慮に入れなければならない。
| 水の温度 |
Kw / 10−14 |
pKw[5] |
| 0°C |
0.112 |
14.95 |
| 25°C |
1.023 |
13.99 |
| 50°C |
5.495 |
13.26 |
| 75°C |
19.95 |
12.70 |
| 100°C |
56.23 |
12.25 |
脚注
- ^ Zhou HX, Rivas G, Minton AP (2008). [http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=2826134 “Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences”]. Annu. Rev. Biophys. 37: 375-397. doi:10.1146/annurev.biophys.37.032807.125817. PMC 2826134. PMID 18573087. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=2826134.
- ^ Minton AP. (2001). “The influence of macromolecular crowding and macromolecular confinement on biochemical reactions in physiological media”. J. Biol. Chem. 276 (14): 10577-10580. doi:10.1074/jbc.R100005200. PMID 11279227.
- ^ Livnah O, Bayer EA, Wilchek M, Sussman JL (1993). [http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=46657 “Three-dimensional structures of avidin and the avidin-biotin complex”]. Proc. Natl. Acad. Sci. U. S. A. 90 (11): 5076-5080. PMC 46657. PMID 8506353. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=46657.
- ^ Johnson RJ, McCoy JG, Bingman CA, Phillips GN Jr, Raines RT (2007). [http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=199390 “Inhibition of human pancreatic ribonuclease by the human ribonuclease inhibitor protein”]. J. Mol. Biol. 368 (2): 434-449. doi:10.1016/j.jmb.2007.02.005. PMC 199390. PMID 17350650. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=199390.
- ^ Bandura, Andrei V.; Lvov, Serguei N. (2006). “The Ionization Constant of Water over Wide Ranges of Temperature and Density”. Journal of Physical and Chemical Reference Data 35 (1): 15-30. doi:10.1063/1.1928231. http://www.nist.gov/data/PDFfiles/jpcrd696.pdf.
関連項目
- 酸
- 平衡定数
- Ki Database
- ミカエリス・メンテン式
- 競合阻害
- 水素イオン指数 (pH)
- スキャッチャードプロット

![K_{d} = \frac{[A]^x \cdot [B]^y}{[A_x B_y]}](http://upload.wikimedia.org/math/7/f/6/7f62de1b550ec5bdc05c556bd5c4602d.png)

![K_{d} = \frac{\left[ \mathrm{P} \right] \left[ \mathrm{L} \right]}{\left[ \mathrm{C} \right]}](http://upload.wikimedia.org/math/0/2/d/02d9662e84613b8f2ab83ae3d30de36c.png)
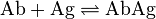
![K_{a} = \frac{\left[ \text{AbAg} \right]}{\left[ \text{Ab} \right] \left[ \text{Ag} \right]} = \frac{1}{K_{d}}](http://upload.wikimedia.org/math/d/0/a/d0af9d86400d19d67b24c34cb1a1c325.png)

 で定義されるpによって表わされることがある。
で定義されるpによって表わされることがある。




