中脳黒質緻密部から得た神経細胞にて、電流固定法(カレントクランプ法)によって観察された、膜電位の変動。脱分極刺激を与えられた神経細胞が8本の活動電位を発生していることが観察される。
膜電位(まくでんい; membrane potential)は細胞の内外に存在する電位の差のこと。すべての細胞は細胞膜をはさんで細胞の中と外とでイオンの組成が異なっており、この電荷を持つイオンの分布の差が、電位の差をもたらす。通常、細胞内は細胞外に対して負(陰性)の電位にある。
神経細胞や筋細胞は、膜電位を素早く、動的に変化させる事により、生体の活動に大きく貢献している。そのため、膜電位とはこれらの細胞の専売特許であるかのように誤解される事も多い。しかし現実には、全ての細胞において膜内外のイオン組成は異なっており、膜電位は存在する。たとえばゾウリムシの繊毛の打つ方向の制御は膜電位の変化によって制御されている。また植物細胞において有名な例としては、オジギソウの小葉が触れる事により閉じるのも、オジギソウの細胞の膜電位の変化によるものである事が知られている。このように、膜電位(とその変化)は、単細胞生物や植物細胞にさえ存在する、生物共通の基本原理である。
目次
- 1 膜電位の概要
- 2 膜電位の基本原理
- 2.1 イオンポンプによるイオンの移動
- 2.2 イオンチャネルによるイオンの移動
- 2.3 膜電位そのものによるイオンの移動
- 3 静止膜電位
- 3.1 静止状態のイオン組成
- 3.2 漏洩チャネルの貢献
- 3.3 静止膜電位時のカリウムイオンの動態
- 3.4 静止膜電位時のナトリウムイオンの動態
- 4 平衡電位
- 4.1 ネルンストの式
- 4.2 ゴールドマン-ホジキン-カッツの式 (GHK方程式)
- 5 脱分極と過分極
- 6 膜電位の測定
- 7 脚注
- 8 参考文献
膜電位の概要[編集]
全ての細胞は、細胞膜によって外界と内部を隔てている。このことは細胞が内部に必要なモノを溜め込むことと、不要なモノを積極的に排除することを可能にしている。必要なモノとしては細胞小器官や種々のタンパク質など、また不要なモノとしては老廃物や毒素などが一番に考えられるが、それ以外にも、細胞は特定のイオンを選択的に取り込み、また別のイオンを選択的に排出することによって、内外のイオンのバランスに差を作っている。最も原始的な生物と考えられているシアノバクテリアにさえ膜電位とそれを利用したイオンチャネルの存在が知られており、このことは生物の誕生と共に膜電位が形成されたことを示唆している。
さて、内外に濃度差を作られたイオンは電荷を持っているので、内外のイオンバランスの差は、内外の電気的ポテンシャルの差をもたらす。つまり、イオンの分布差そのものが、細胞内外に電位の差をもたらすということである。この、イオン分布の差による細胞内外の電位差を、膜電位と呼ぶのである。
仮に膜外に100個の1価の陽イオンがあり、膜内に40個の1価の陽イオンがあるという状況を想定する。この場合、膜外は膜内に対して、イオン60個分のプラスの電位差を持っているといえる(逆に、膜内は膜外に比べ、イオン60個分マイナスの電位差があるといえる)。このように、膜電位とは膜内外の陰陽両イオンの電荷の総和で決定される。現実には膜内外に存在するイオンは一種類ではなく、またイオン種によって価数も違うため、計算は容易ではない。また、電荷バランスが崩れた領域は、膜の近傍の2~3nm(デバイ長)のところのみである。したがって、大部分の電荷は膜表面付近に集中する。電位差の計算については、後に詳述する。
では膜電位は一体何故必要なのだろうか。1つには、細胞内外に大きな電位の差を作っておけば、その電位の差を利用した非常に早い情報伝達が可能になるという利点がある。これはイオンによる電位差とその開放によるエネルギーという概念を、ダムによる水位の差とその開放によるエネルギーによっての水力発電と置き換えて考えるとわかりやすいだろう。つまり、電位差(水位差)を一気にイオンチャネル(水門)を開くことによって力を解き放つと、大きく、かつすばやい駆動力を生み出すことが可能になるのである。
膜電位の基本原理[編集]
細胞膜の重要な性質の1つとして、細胞膜を構成する脂質二重層の内部は疎水性であるということがあげられる。このため、イオンは細胞膜を介して自由に行き来することができない。そのため、一旦生じたイオン組成の差は、そのまま細胞膜内外の電荷の差の原因となる。つまり、膜電位が生じるためにはそもそも細胞内外のイオン分布に差が生じる必要がある。以下、イオン分布の差を引き起こす要素について詳述する。
イオンポンプによるイオンの移動[編集]
イオン分布の差を生じさせる第一の要素として、イオンポンプの存在が挙げられる。イオンポンプはATP等のエネルギーを利用して、特定のイオンを能動輸送するタンパク質である。このイオンポンプは膜内外のイオン組成の違いがどういう条件であろうと、一方から他方へ、能動的に常に一方通行のイオン輸送を担う。
イオンポンプの輸送速度はそれほど速くなく、1分子のポンプ1秒あたりせいぜい数百のイオンを輸送できるにとどまるが、ATPのエネルギーがある限り常に動き続ける。実際には生きた細胞内でATPが枯渇する事は考えられないため、結果的にイオン分布変化への貢献度はそれなりに大きくなる。
膜電位に関わるイオンポンプとして、もっとも有名かつ研究がなされたものとして、ナトリウム-カリウムポンプ(Na+-K+ ATPアーゼ; ナトリウムポンプとも)が挙げられる(右図)。これはATPの加水分解によるエネルギーを利用して3個のナトリウムイオン(Na+)を細胞外に汲み出すと共に、2個のカリウムイオン(K+)を細胞内に汲み込むタンパクである。このタンパクが働いているおかげで、細胞内はナトリウムイオンが少なく、カリウムイオンが多いという条件を維持できるのである。そのほかにもカルシウムイオン(Ca2+)や水素イオン(H+)を輸送するポンプなども存在し、成分としては小さいものの、膜電位に貢献している。
イオンチャネルによるイオンの移動[編集]
イオンチャネルを介したイオンの移動: イオンの膜を横切る移動は通常さえぎられるが、イオンチャネルにぶつかったイオンだけが、方向は非選択的に膜を横切る様子。
詳細は「イオンチャネル」を参照
次に、イオンポンプなどの活動により一旦イオン分布の差が生まれると、今度はその濃度差を利用した受動輸送が可能になる。この受動輸送は、イオンチャネルと呼ばれるタンパク質によってなされる。イオンチャネルは、イオンポンプ等によって濃度差が作られたイオンを、イオン濃度の高いほうから低いほうへ拡散させる、イオンの通り道である。よって、方向に選択性はなく、膜電位がない場合は常にイオンの濃度勾配に従った輸送である。 ただし、イオン濃度の低い方から高い方への移動が全くないわけではないことに注意すべきである。イオンがチャネルを通過するかどうかはそのイオンがブラウン運動によってチャネル分子に衝突するかどうかに依存しており、イオン濃度の高い側では、イオンのチャネルへの衝突が、低いほうに比べて圧倒的に起きやすいため、全体としては高い方から低い方への流れが生じるわけである。
イオンチャネルの多くは通常不活性型であり、何らかの刺激(膜電位の変化・リガンドの結合・リン酸化・機械刺激など)に応じて開閉する。そのため、定常状態の細胞において、働いているイオンチャネルは少ないと言える。ただし、漏洩チャネルと呼ばれるタイプのイオンチャネルは常に開いており、静止膜電位に貢献する(後述)。
膜電位そのものによるイオンの移動[編集]
膜内外の電位差そのものも、イオンの移動に影響を及ぼす。たとえば、静止状態の膜電位は細胞内が細胞外に比べて負であることはすでに述べたが、負の細胞内に向けて陽イオンは入りやすく、陰イオンは入りにくい。逆に、正の細胞外に向けて陰イオンは出て行きやすく、陽イオンは出て行きにくい。これは、単純に細胞外の正電荷を持つ環境が、陽イオンを反発させようとするからである。現実に、塩化物イオン(Cl-)の移動は細胞膜を通してかなり自由度が高いため、この膜電位による移動にほとんど依存している。
静止膜電位[編集]
このように、いくつものタンパクの作用により、イオンは常に、絶えず細胞内外を移動している。イオンの流出入は細胞が生きている限り止まることはないが、電荷の移動はある条件において見かけ上動かなくなる。この条件をもたらす膜電位を静止膜電位(せいしまくでんい; Resting Membrane Potential)という。この条件において、細胞は一種の定常状態にあり、見かけ上電荷の移動はなく、膜電位は安定する。ただし、この条件においてもイオンの流出入は続いていることに注目すべきである。つまり、単位時間当たりに流出するイオンの総電荷量と流入するイオン総電荷量が一致しており、かつその状態が長く続くような条件が、静止膜電位である。
静止状態のイオン組成[編集]
神経細胞を例に取れば、一般にナトリウムイオン(Na+)や塩化物イオン(Cl-)は細胞内に少ない。その代わり、カリウムイオン(K+)濃度は高く、また負電荷を持つ有機低分子(アスパラギン酸など)の濃度が高い。これらはチャネル分子の存在による膜の選択的透過性と、イオンポンプによる能動輸送が関与している。ただし、細胞膜の塩化物イオンに対する選択的透過性はかなり低いため、塩化物イオンは比較的自由に膜内外を行き来することができる。それでも塩化物イオン濃度が細胞外において高いのは、細胞外が細胞内に比べて正電荷を持つため、膜電位による電場によって受動的に引き寄せられるためである(前述「膜電位そのものによるイオンの移動」参照)。
その他、カルシウムイオンCa2+やマグネシウムイオンMg2+も比較的細胞内には少ない。特に、カルシウムイオン濃度が細胞内において少なく維持されていることは、細胞にとって大変重要である。カルシウムイオンは必要に応じて細胞外や、小胞体から細胞内に放出され、カルモジュリンやカルシウム依存性キナーゼ等、種々のカルシウム依存性タンパク質を活動させる引き金であり、たくさんのシグナル伝達カスケードを動かす最初のキューとして非常に大切である。そのため、カルシウムは細胞外への輸送だけでなく、小胞体内へも能動輸送され、細胞内濃度を低く保っている。
漏洩チャネルの貢献[編集]
神経細胞の典型的な軸索において、静止膜電位は負であり、おおよそ-70mV程度である。このことは、細胞外に陽イオンが比較的多い(もしくは細胞内に陰イオンが比較的多い)ことを示唆している。実際には前者が正しい。前述したNa+-K+交換イオンポンプは3個のナトリウムイオンと2個のカリウムイオンを交換しているだけなので膜電位の変化にはそれほど大きく寄与しないが、外にくみ出されたナトリウムイオンが細胞内に入り込むためのナトリウムチャネルは通常不活性化されており、開いていないのに対し、カリウムが細胞外に流出するカリウムチャネルの中には、通常開きっぱなしのものが存在する。つまり、カリウムイオンは汲み入れても汲み入れても、ある程度は細胞外に漏れ出て行ってしまうのである。これが、静止膜電位が負になってしまう主な原因である。このカリウムイオンを漏れ出させてしまうチャネルを、カリウム漏洩チャネルと呼ぶ。
静止膜電位時のカリウムイオンの動態[編集]
静止膜電位の状態におけるカリウムイオンの移動の概略。
(
P): Na
+-K
+交換ポンプの作用に寄るイオン移動、(
E): 膜電位そのものの電場によって引き寄せられる電気化学的なイオンの移動、(
L): 漏洩チャネルによるイオン移動、(
F):静止膜電位時にカリウムチャネルが開いた時のカリウムイオンの透過力。
左図の(P)と(E)が主要な内向きのカリウムイオンの移動である。この2者による内向きの移動の合力(P+E)が大きな値になることは図から明らかだろう。しかし、脊椎動物の静止膜電位は-70mV付近であり、そこからカリウムチャネルが開いても、せいぜい-90mV程度(カリウムの平衡電位)、つまり20mV分程度しか膜電位は変化しない。つまり内向きの大きな力を相殺するだけの外向きのイオン流が最初から存在しなければ説明がつかないことになる。事実その外向きのイオン流を実現しているのが(L)、前述の漏洩チャネルからのイオンの流出による。漏洩チャネルによる外向きイオン流があるので、実際に静止膜電位からカリウムチャネルが開いた時のカリウムイオンの流出は(F)程度となる。
静止膜電位時のナトリウムイオンの動態[編集]
静止膜電位の状態におけるナトリウムイオンの移動の概略。
(
P): Na
+-K
+交換ポンプの作用に寄るイオン移動、(
E): 膜電位そのものの電場によって引き寄せられる電気化学的なイオンの移動、(
F):静止膜電位時にナトリウムチャネルが開いた時のナトリウムイオンの透過力。
次にナトリウムイオンに関しては右図に注目する。まず、上述カリウムイオンの透過と異なり、 Na+-K+交換ポンプの作用に寄るイオン移動(P)が逆方向であることに注目すべきである。電気化学的なイオンの移動(E)は同方向であるので、ポンプによる電流が電気化学的移動を多少相殺していることになる。しかし、ナトリウムイオンはほとんど細胞内に漏洩しないので、ナトリウムチャネルが開くと大きな透過力(F)を発生することになる。これが活動電位の正体であり、この大きな力により、-70mV程度の膜電位は、+40mV付近まで一気に変化する。
平衡電位[編集]
前述のように、イオンの流れは膜電位そのものが起こす電場の影響を受ける。電場によって起こされるイオン移動は受動的なものであり、電場を打ち消すような方向に行われるため、ある一定の膜電位において、そのイオンの移動が見かけ上停止する点がある。それを平衡電位(へいこうでんい; Equilibrium Potential)と呼ぶ。細胞膜のそれぞれのイオンに対する選択的透過性は異なるため、平衡電位はそれぞれのイオンについて別々に存在する。
ネルンストの式[編集]
平衡電位を求めるためには、ドイツの化学者、ヴァルター・ネルンストによって導かれたネルンストの式を利用する。
![E_{ion} = \frac{RT}{z{\rm F}} \ln\frac{[ion]_o}{[ion]_i}](//upload.wikimedia.org/math/9/2/6/9262f4561f0321655286a4fb516e37ee.png)
ただし、lnは自然対数(eを底とする対数)であり、他のパラメータは以下のとおりである。
- R=気体定数(8.31J/mol/K)
- T=絶対温度(℃+273)
- z=イオンの荷数
- F=ファラデー定数(1molあたりの電荷、96500クーロン/mol)
- [ion]o=細胞外のイオン濃度
- [ion]i=細胞内のイオン濃度
ここで哺乳類の体細胞における1価の陽イオンに限って考えれば、Z=1、T=37+273=310を代入して;
![E_{ion} = 26.7 \ln\frac{[ion]_o}{[ion]_i}](//upload.wikimedia.org/math/3/6/e/36e5016c711a6c6ba4245e060935bb62.png)
となり、平衡電位は膜内外のイオン濃度(厳密には活量)によってのみ決定されていることがわかる。このことは二つの意味で重要である。ひとつは、平衡電位は膜電位によって影響されないということである。様々なイオンの平衡電位の総和は、膜電位を決める重要な要素であるが、平衡電位そのものが膜電位に影響を受けることはない。もうひとつは、その様々な他のイオンの存在にも関係なく、平衡電位は決まるということである。言い換えれば、他のイオンの作る電場に、平衡電位は影響されない。[1]
哺乳類の典型的な神経細胞内のイオン濃度と、体液の組成による細胞外イオン濃度は以下のとおりであるので、これらより、平衡電位を計算することが可能である。
| *** |
カリウムイオン(K+) |
ナトリウムイオン(Na+) |
塩化物イオン(Cl-) |
| 細胞外 |
5.5mM |
135mM |
125mM |
| 細胞内 |
150mM |
15mM |
9mM |

以上からわかるとおり、見かけ上イオンの移動が停止する膜電位は、カリウムイオンについては-88mV、ナトリウムイオンは+59mVということである。逆に言えば、カリウムイオンは膜電位が-88mVになるまで、ナトリウムイオンは+59mVになるまで移動を続けようとするということである。このことは神経細胞の活動電位の発生時に観察することができる。活動電位が発生するとき、軸索上のナトリウムチャネルが開放され、ナトリウムイオンの細胞膜内外の行き来は自由になる。そのため、膜電位は+59mVに向けて変動する。これが活動電位のスパイクの正体である。その後ナトリウムチャネルは不活性化されて閉じ、今度は電位依存性のカリウムチャネルが開放される。そこで今度は、膜電位は-88mVに向けて下降し、静止膜電位である-70mV付近を越えてアンダーシュートするのである。
ゴールドマン-ホジキン-カッツの式 (GHK方程式)[編集]
前述したネルンストの式は、それぞれのイオンについて、その流れが見かけ上止まる点を導き出す式であり、膜電位そのものは算出できない。膜電位を算出するためには、各イオン電流の和が0になる電位を求める必要があり、そのために導出されたのが、ゴールドマン-ホジキン-カッツの式(Goldman-Hodgkin-Katz Equation)、あるいはGHK方程式である。GHK方程式では、細胞膜を透過するイオンをすべて考えるのが、ネルンストの式との最大の違いである。ただしGHK方程式の導出においては、扱う対象のイオンの価数の絶対値が等しいことと、膜内部の電位勾配が一定とした仮定(constant field theory)を用いている。
ここで、細胞膜を透過するイオンがK+、Na+、Cl-のみと仮定すると、膜電位Emは以下の式で表される。
![E_m = \frac{RT}{F} \ln\frac{P_K[K^+]_o\ +P_{Na}[Na^+]_o\ +P_{Cl}[Cl^-]_i}{P_K[K^+]_i\ +P_{Na}[Na^+]_i\ +P_{Cl}[Cl^-]_o}](//upload.wikimedia.org/math/5/8/1/581f965f55b72589289abf2088a7bcfd.png)
PK、PNa、PClは、それぞれのイオンの透過係数であり、また、生体内においてはおおよそPK : PNa : PCl = 1 : 0.04 : 0.45程度であるので、
- PNa = 0.04PK
- PCl = 0.45PK
さらに前述の細胞内外のナトリウム・カリウムイオンおよび塩化物イオン濃度を代入すると、
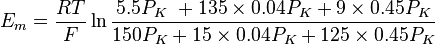
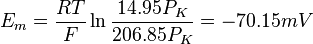
となり、おおむね実測値となることがわかる。このとき、イオンxの透過係数(Px)の絶対値そのものは必要ない。透過係数はイオンのコンダクタンス(抵抗値の逆数)と密接に関わる量であるが、現実には算出は容易でない。GHK方程式の便利な点は、透過係数の比のみで膜電位の値が求まることである。
さらに、ナトリウムイオンと塩化物イオンの透過性がゼロの条件を考えると、PNa=PCl=0より、
![E_m = \frac{RT}{zF} \ln\frac{[K^+]_o}{[K^+]_i} \qquad (z=+1)](//upload.wikimedia.org/math/f/8/d/f8ddf5750dc88a9488ea35bf5855528f.png)
となり、膜電位がカリウムの平衡電位と同じになる。この式はネルンストの式と全く同じである。
また、GHK方程式の自然対数部において、細胞内イオン濃度と細胞外イオン濃度の項が、陽イオンと陰イオンで逆になる。これは、GHK方程式に、PK=PNa=0を代入した場合、下式のようにCl-(z=-1)に対するネルンストの式になることに対応している。
![E_m = \frac{RT}{F} \ln\frac{[Cl^-]_i}{[Cl^-]_o}= \frac{RT}{zF} \ln\frac{[Cl^-]_o}{[Cl^-]_i} \qquad (z=-1)](//upload.wikimedia.org/math/4/9/9/4995e6a1a3fbf32c771ef1c83ca692d0.png)
脱分極と過分極[編集]
詳細は「活動電位」を参照
細胞膜は静止膜電位で定常状態を保っている。この状態を、膜が分極(ぶんきょく)しているという。ここからプラス方向に膜電位が変化することを脱分極(だつぶんきょく; depolarization)、さらにマイナス方向に変化することを過分極(かぶんきょく; hyperpolarization)と表現する。脱分極は必ずしも、膜電位が正に変化することを伴わず、-70mVから-30mVへの変化でも、十分脱分極である。また、一旦プラスに転じた膜電位が再度静止膜電位に戻ることを、再分極(さいぶんきょく)という。
神経細胞はシナプスと呼ばれる構造を通じて情報の伝達をしているが、伝達を受けた神経細胞が脱分極するか過分極するかは重要なポイントである。それは、脱分極を引き起こす伝達は「興奮性伝達」と呼ばれ、活動電位を引き起こす助けとなるのに対し、過分極を引き起こす伝達は「抑制性伝達」と呼ばれ、活動電位の発生を抑える働きをする。活動電位の発生は、入力された興奮性/抑制性伝達の総和がある一定の値(閾値という)に達するかどうかによって決定されるので、個々のシナプスが興奮性であるか、抑制性であるかは神経回路を理解するうえで大変重要なのである。
膜電位の測定[編集]
膜電位を電気的に測定するためには、細胞内外にそれぞれ一本ずつ電極をおくことが必要となる。細胞外は良いとして、細胞内に電極を刺すことはなかなか困難である。これを最初に可能にし、膜電位を測定したのがイギリスの神経科学者、アラン・ホジキンとアンドリュー・ハクスレーということになっている(後述)。彼らはイカの巨大軸索を用いて、膜電位とその変化を観察した功績から、1963年のノーベル生理学・医学賞を受賞した。イカの巨大軸索は直径1mm近くあるので、内部に金属製のワイヤを差し込むことが比較的容易だったためである。
パッチクランプ法の概略図。ここではガラス管電極によって囲んだチャネルから流れる電流を測定しているが、ガラス管内と細胞内を隔てる部分の細胞膜を破ることによって、細胞全体を行き来する電流を測定することも可能である。
しかし、今日では細胞内にワイヤを刺すことはまず行われず、電解液で満たした細いガラス管電極を細胞にあてて、膜電位を測定するのが主流である。細胞内に直接電極が刺さっていなくても、測定電極と電解質溶液が連続している限り、なんら問題はなく膜電位は測定できるからである。この技術はパッチクランプ法と呼ばれ、神経科学研究の大切な技術の一つである。また、これ自体1991年のノーベル生理学・医学賞受賞技術である。
しかし、ホジキン(1955)やハクスレー(1951)に先行すること10年以上前、日本人の科学者、鎌田武雄が英国留学中にゾウリムシの膜電位の測定に成功していた(1934)。しかも彼はこの時点ですでにガラス管電極を発明して用いており、ノーベル賞級の技術を二つ同時に駆使していたことになる。
今日でも、パッチクランプ法はもっとも主要な膜電位の測定技術であるが、1970年代から、細胞膜に溶け込み、膜電位の変化に応じて蛍光あるいは吸光が変化する、膜電位感受性色素と言う化学物質がYale大学のLarry Cohen教授のグループ(Lary Cohen (Yale Univ), Brian Salzberg (Univ Penn), Amiram Grinvald (Weizmann Inst), Bill Ross (NY Med Coll), Kohtaro Kamino (Tokyo Med Dent Univ))によって発明され、光学的に膜電位変化を計測する方法が確立された。測定システムは当初市販のものはなく、Larry Cohenらのグループは、フォトダイオードアレイを用いた測定機器を開発して、様々な標本にこれを応用した。日本においては、開発者のひとりである東京医科歯科大学 神野耕太郎名誉教授が初めて導入し、自前でフォトダイオードアレイを用いた測定機器を開発・改良して測定を開始し、心臓や神経系の機能発生・機能形成の研究を展開している。この方法は非常に微細な蛍光あるいは吸光変化を検出しなければならないためまだ精度がさほど良くなく、非常に高性能な光学検出系が必要であり、また色素そのものの毒性も報じられていることなどから測定は難しいが、今後の研究の発展に寄与するものとして期待が寄せられている。
脚注[編集]
- ^ 膜表面に存在する電荷がデバイ遮蔽される程度がイオン濃度に依存することや、膜表面にあるリン酸部分の負電荷の存在によって、膜近傍の電位の構造は複雑になるが、このことが、電位感受性のイオンチャネルのゲーティングに影響を与えることはあっても、平衡電位には影響を与えない。
参考文献[編集]
- Bertil Hille, Ionic Channel of Excitable Membranes Macmillan Education Australia (1984/11/30). ISBN 0-87893-322-0
- Nicholls, J.G., Martin, A.R. and Wallace, B.G. From Neuron to Brain Sinauer Associates Inc; 4th Edition (2001/1/15). ISBN 0-87893-580-0
- Kamada, T. Some observations on potential defference across the ectoplasm membrane of Paramecium. J. Exp. Biol. 11, 94-102 (1934)
- Delcomyn, F. (translation by Ogura, A., Tominaga, K.) ニューロンの生物学 南江堂 (2000/12). ISBN 4-524-22431-9
- 岡 良隆:「基礎から学ぶ 神経生物学」,オーム社,ISBN:978-4-274-21195-9,(2012年5月).
![E_{ion} = \frac{RT}{z{\rm F}} \ln\frac{[ion]_o}{[ion]_i}](http://upload.wikimedia.org/math/9/2/6/9262f4561f0321655286a4fb516e37ee.png)
![E_{ion} = 26.7 \ln\frac{[ion]_o}{[ion]_i}](http://upload.wikimedia.org/math/3/6/e/36e5016c711a6c6ba4245e060935bb62.png)

![E_m = \frac{RT}{F} \ln\frac{P_K[K^+]_o\ +P_{Na}[Na^+]_o\ +P_{Cl}[Cl^-]_i}{P_K[K^+]_i\ +P_{Na}[Na^+]_i\ +P_{Cl}[Cl^-]_o}](http://upload.wikimedia.org/math/5/8/1/581f965f55b72589289abf2088a7bcfd.png)
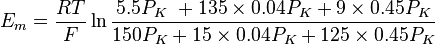
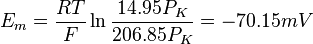
![E_m = \frac{RT}{zF} \ln\frac{[K^+]_o}{[K^+]_i} \qquad (z=+1)](http://upload.wikimedia.org/math/f/8/d/f8ddf5750dc88a9488ea35bf5855528f.png)
![E_m = \frac{RT}{F} \ln\frac{[Cl^-]_i}{[Cl^-]_o}= \frac{RT}{zF} \ln\frac{[Cl^-]_o}{[Cl^-]_i} \qquad (z=-1)](http://upload.wikimedia.org/math/4/9/9/4995e6a1a3fbf32c771ef1c83ca692d0.png)





