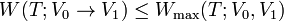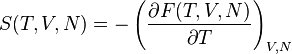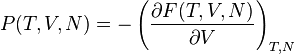- 英
- free energy
- 関
- エネルギー
Wikipedia preview
出典(authority):フリー百科事典『ウィキペディア(Wikipedia)』「2013/04/19 17:15:02」(JST)
wiki ja
UpToDate Contents
全文を閲覧するには購読必要です。 To read the full text you will need to subscribe.
- 1. 思春期における食物エネルギー所要量 dietary energy requirements in adolescents
- 2. 中等症から重症熱傷患者に対する栄養所要量および経腸栄養剤 nutritional demands and enteral formulas for moderate to severe burn patients
- 3. 肥満の病因 pathogenesis of obesity
- 4. 筋肉におけるエネルギー代謝 energy metabolism in muscle
- 5. HIV感染男性における性腺機能低下 hypogonadism in hiv infected males
Japanese Journal
- 誰でもわかる化学熱力学(7)エントロピーと自由エネルギー
- 中田 宗隆
- 現代化学 (489), 53-57, 2011-12
- NAID 40019072045
- QM/MM法と溶液の理論の融合による凝縮系の化学過程の自由エネルギー計算(13)凝縮系の第一原理計算の方法論について
- 高橋 英明
- アンサンブル : 分子シミュレーション研究会会誌 13(4), 157-160, 2011-10
- NAID 40019066732
Related Links
- マピオン大百科へようこそ。このページは自由エネルギーに関する情報を掲載しています。気になる人物、知りたい事件があったらすぐに検索! ... 自由エネルギー(じゆうエネルギー、英: free energy )とは、熱力学における状態量の1つで ...
- 自由エネルギー(じゆうエネルギー、free energy)とは、熱力学における状態量の1つである。熱力学第一法則から導いた式によりエネルギーの収支を、第二法則から得た式によりある過程の進行の自発性を扱えるので、十分な物理量を得ると ...
Related Pictures








★リンクテーブル★
| リンク元 | 「ピロリン酸」「Helmholtz free energy」 |
| 拡張検索 | 「標準自由エネルギー変化」「Gibbs自由エネルギー」 |
| 関連記事 | 「エネルギー」「自由」 |
「ピロリン酸」
- 英
- pyrophosphate, PPi, pyrophosphoric acid
- 同
- 二リン酸 diphosphoric acid、焦性リン酸 pyrophosphoric acid、無機ピロリン酸 inorganic pyrophosphate
- 関
- 自由エネルギー
「Helmholtz free energy」
- 同
- Helmholtz's free energy
- 関
- 自由エネルギー
「標準自由エネルギー変化」
■反応の速度
実際に標準自由エネルギーが負であるからといって、反応が自発的にどんどん進むことはなく、活性化エネルギーあるいは触媒の供給が必要である。
■平衡定数とΔGの関係 物質Aの濃度と自由エネルギーの関係はほぼ次式で表される GA - G゜A = RT [A] GA :部分モル自由エネルギー、化学ポテンシャル G゜A:標準状態での部分モル自由エネルギー
aA + bB ⇔ cC + dD この反応の反応に伴う自由エネルギー変化ΔGは ΔG = c * G c + d * G d - a * G a - b * G b 標準状態では ΔG゜ = c * G゜c + d * G゜d - a * G゜a - b * G゜b
[C]^c * [D]^d
ΔG = ΔG゜ + RT ln -------------
[A]^a * [B]^b
平衡状態では
[C]^c * [D]^d
ΔG゜ = - RT ln ------------- = - RT Keq
[A]^a * [B]^b
Keqは平衡定数なので
[C]^c * [D]^d
Keq = ------------- = exp( -ΔG゜/RT )
[A]^a * [B]^b
ΔG゜= - RT ln Keq //
- 英
- standard free energy change
- 英
- standard free energy
「Gibbs自由エネルギー」
「エネルギー」